তড়িৎ কোষ যাকে ইংরেজি পরিভাষায় সাধারণভাবে ব্যাটারি (Battery) বলে। যা সাধারণত ফ্ল্যাশলাইট, মোবাইল ফোন , ব্যাকআপ লাইট , টর্চলাইট , চার্জার ফ্যান এবং বৈদ্যুতিক গাড়ির মতো বৈদ্যুতিক যন্ত্রকে সচল রাখতে প্রয়োজনীয় বৈদ্যুতিক শক্তি সরবরাহ করার জন্য ব্যবহৃত হয়। ১৭৯৪ সালে আলেসান্দ্রো ভোল্টা সর্বপ্রথম তড়িৎ কোষ আবিষ্কার করেন। এটি সরলতম তড়িৎ কোষ। ব্যাটারিতে কার্বন দণ্ড ধনাত্মক পাত এবং দস্তার পাত ঋণাত্মক পাত হিসেবে কাজ করে। তরল হিসেবে সালফিউরিক এসিড এবং ছেদন নিবারক হিসেবে ম্যাঙ্গানিজ ডাই-অক্সাইড ব্যবহার করা হয়। ব্যাটারির ধনাত্মক প্রান্তকে অ্যানোড এবং ঋণাত্মক প্রান্তকে ক্যাথোড বলে। এ ব্যাটারি থেকে ডিসি কারেন্ট পাওয়া যায়। ব্যাটারির তড়িচ্চালক বল ১.৫ ভোল্ট। সাধারণ স্টোরেজ ব্যাটারিতে সীসার ইলেকট্রোডের সাথে সালফিউরিক এসিড ব্যবহৃত হয়। বর্তমানে সৌর চুল্লীতে স্টোরেজ ব্যাটারি ব্যবহার করে ডিসি বিদ্যুৎ সরবরাহ করা হয়। স্টোরেজ ব্যাটারির সাহায্যে দিনের সৌরশক্তিকে সঞ্চিত করে রাতেও ব্যবহার করা যায়। যানবাহনে পেট্রোল ট্যাংক যেমন জ্বালানি বহন করে স্টোরেজ ব্যাটারিও তেমনি সৌরশক্তি ধরে রাখে। সূর্য যখন কিরণ দেয় তখন স্টোরেজ ব্যাটারি ছাড়াও পাওয়ার সাপ্লাই পাওয়া যায়, কিন্তু সূর্য যখন কিরণ দেয় না তখন সোলার প্যানেলের মাধ্যমে পাওয়ার সাপ্লাই পেতে গেলে স্টোরেজ ব্যাটারি প্রয়োজন হয় ।
তড়িৎ কোষ
যে যন্ত্রের সাহায্যে রাসায়নিক শক্তি বা অন্য শক্তি হতে তড়িৎ শক্তি উৎপন্ন করে বৈদ্যুতিক যন্ত্রকে সচল রাখতে প্রয়োজনীয় বৈদ্যুতিক শক্তি সরবরাহ করার জন্য তড়িৎ প্রবাহ বজায় রাখা হয় তাকে তড়িৎ কোষ (Electric cell) বলে। যেমন-- রাসায়নিক কোষ (Chemical cell), সৌর কোষ (Solar cell), আলোক তড়িৎ কোষ (Photoelectric cell)। সচল যন্ত্রাংশযুক্ত তড়িৎ কোষ হলো ডায়নামো (Dynamo)।
তড়িৎ কোষের প্রকারভেদ: তড়িৎ কোষ দুইপ্রকার যথাঃ
১. তড়িৎ রাসায়নিক কোষ বা গ্যালভানিক সেল ।
২. তড়িৎ বিশ্লেষ্য কোষ
১ . তড়িৎ রাসায়নিক কোষ: যে যন্ত্রের সাহায্যে রাসায়নিক বিক্রিয়া ঘটিয়ে রাসায়নিক শক্তিকে সরাসরি বিদ্যুৎ শক্তিতে অথবা বিদ্যুৎ শক্তি ব্যবহার করে রাসায়নিক বিক্রিয়া ঘটানো হয় তাকে তড়িৎ রাসায়নিক কোষ বলে। আবিষ্কারক: আলেসান্দ্রো ভোল্টা ।
তড়িৎ রাসায়নিক কোষ আবার দুই প্রকার যথাঃ প্রাথমিক/ মৌলিক কোষ এবং গৌণ ও সঞ্চয়ী কোষ । যা নিচের টেবিলে দেখানো হলঃ
| প্রাথমিক / মৌলিক কোষ | গৌণ ও সঞ্চয়ী কোষ |
|---|---|
| ১. এক তরল কোষ (লেকল্যান্স কোষ) | ১. লেড ( সঞ্চয়ী কোষ ) |
| ২. দুই তরল কোষ (ড্যানিয়েল কোষ) | ২. নিকেল অক্সাইড ( সঞ্চয়ী কোষ ) |
| ৩. শুষ্ক কোষ |
প্রাথমিক / মৌলিক কোষ
প্রাথমিক ব্যাটারি বা কোষ রিচার্জেবল নয় । ব্যবহারের জন্য এগুলো এমনভাবে ডিজাইন করা হয় যার শক্তি নিঃশেষ হয়ে গেলে আর ব্যবহার করা যায় না । এগুলিকে পুনরায় চার্জ করা যায় না। যে কারণে একবার ব্যবহারের পর তা ফেলে দেওয়া হয়। এগুলির রাসায়নিক বিক্রিয়াগুলি সাধারণত উভমুখী হয় না, তাই যখন ব্যাটারিতে বিক্রিয়কের সরবরাহ শেষ হয়ে যায়, তখন ব্যাটারি কারেন্ট উৎপাদন বন্ধ করে দেয় এবং অকেজো হয়ে যায়। উদহারণস্বরুপ বলা যায় টর্চলাইটের ব্যাটারি যা একবার ব্যবহারের পর ফেলে দিতে হয় । এগুলি তিন ধরনের হতে পারে যথাঃ ১. এক তরল কোষ (লেকল্যান্স কোষ) ২. দুই তরল কোষ (ড্যানিয়েল কোষ) ৩. শুষ্ক কোষ
☞ লেকল্যান্স কোষ
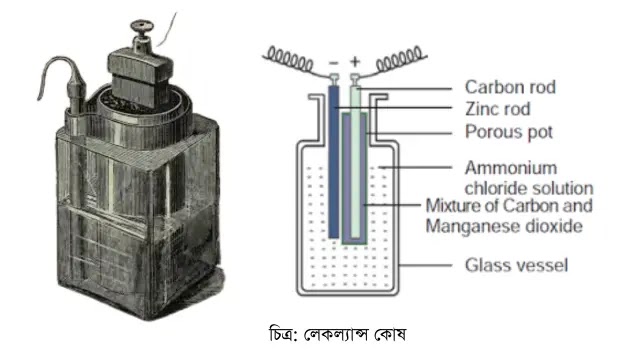
১৮৬৫ সালে জর্জ লেকল্যান্স এই কোষ উদ্ভাবন করেন। যে কারণে তার নামানুসারে এই কোষের নামকরণ করা হয় লেকল্যান্স কোষ বা সেল । একটি কাচের বড় ঘন পাত্রে আ্যমোনিয়াম ক্লোরাইড দ্রবনের মধ্যে একটি পারদের প্রলেপ দেয়া দস্তার দন্ড ডুবিয়ে এই ধরনের কোষ বানানো হয়ে থাকে।এই দন্ড ঋণাত্মক মেরু হিসাবে কাজ করে। কাচ পাত্রের মাঝখানে একটি সূক্ষ ছিদ্রযুক্ত পাত্র রাখা হয়।পাত্রটির মধ্যে একটি কার্বন দন্ডের চারদিকে কাঠকয়লার গুঁড়া,ম্যাঙ্গানিজ ডাই-অক্সাইড থাকে।কার্বন দন্ডটি ধণাত্মক মেরু হিসাবে কাজ করে। গ্যাস বেড়িয়ে যাওয়ার জন্য সচ্ছিদ্র পাত্রের উপরে একটি সরু ছিদ্র থাকে। আ্যমোনিয়াম ক্লোরাইড এই কোষের সক্রিয় তরল এবং ম্যাঙ্গানিজ ডাই-অক্সাইড পোলারন নিবারক। কাচ পাত্রের মুখ পীচ দিয়ে বন্ধ করা থাকে এবং দস্তা ও কার্বন দন্ডের মাথায় সংযোগ স্ক্রু লাগানো থাকে।
☞ ড্যানিয়েল কোষ বা গ্যালভানিক কোষ
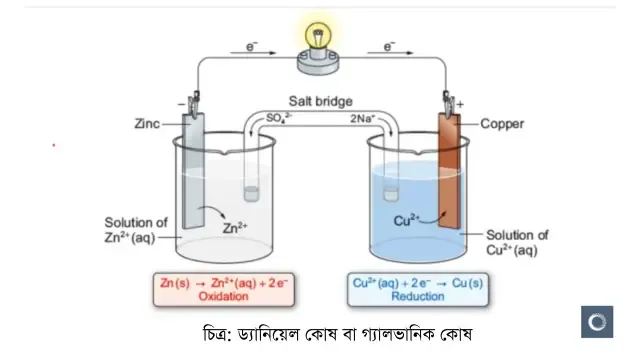
গ্যালভানিক বা ড্যানিয়েল কোষ হলো এক ধরনের তড়িৎ রাসায়নিক কোষ । যার মাধ্যমে রাসায়নিক শক্তি তড়িৎ শক্তিতে রূপান্তরিত হয়। দুটি আলাদা ধাতুর তৈরি তড়িতদ্বারকে একটি লবণ সেতুর সংযোগের মাধ্যমে এটি তৈরি করা হয়। একে ভলটায়িক কোষ বা ইলেকট্রোকেমিক্যাল কোষও বলা হয়ে থাকে। ১৭৮০ সালে লুইজি গ্যালভানি আবিষ্কার করেন যে, দুটি ভিন্ন ধাতু যেমন: তামা ও দস্তাকে একসাথে যুক্ত করে একটি ব্যাঙের একটি স্নায়ুর আলাদা অংশে যুক্ত করলে পা দুটি দুলে ওঠে। তিনি এটিকে প্রাণী বিদ্যুৎ বলে আখ্যা দেন। ১৮০০ সালের দিকে আলেসান্দ্রো ভোল্টার তৈরি ভোল্টায়িক পাইল গ্যালভানিক কোষের অনুরূপ। এই আবিষ্কার ব্যাটারী বা বিদ্যুৎ কোষ আবিষ্কারের পথ সুগম করে।
গঠন ও ক্রিয়া কৌশল : একটি গ্যালভানিক কোষে দুটি অর্ধকোষ থাকে। প্রতিটি অর্ধকোষে একটি ইলেকট্রোড যা জিঙ্ক ও কপারের পাত এবং একটি ইলেকট্রোলাইট যা এদের জলীয় দ্রবণ ZnSO4 ও CuSO4। ধাতব ইলেকট্রোডের ধাতু মিশ্রণের সাথে দ্রবীভূত হতে পারে এবং এর ফলে ইলেকট্রোলাইটে ধনাত্মক আয়ন যুক্ত হয় এবং ইলেকট্রনে ঋনাত্মক চার্জযুক্ত ইলেকট্রোড থাকে। এভাবে সকল অর্ধকোষে নিজস্ব অর্ধ-বিক্রিয়া ঘটে। চিত্রে প্রদর্শিত ডেনিয়েল কোষে Zn অনুর দ্রবীভূত হবার প্রবণতা Cu অণু থেকে বেশি। নির্দিষ্ট করে বললে, জিঙ্ক ইলেকট্রোডের ইলেকট্রনগুলোতে কপার ইলেকট্রোডের ইলেকট্রনের তুলনায় বেশি শক্তি থাকে। কেননা ইলেকট্রনের আধান ঋনাত্মক, এখন ইলেকট্রনকে আরো শক্তি দিতে হলে জিঙ্ককে কপারের চেয়ে বেশি ঋনাত্মক ইলেকট্রিকাল পোটেনশিয়াল থাকতে হবে। অবশ্য ইলেকট্রোডদ্বয়ের মধ্যে বাহ্যিক সংযোগ না থাকলে বিদ্যুত প্রবাহিত হয় না।
যখন ইলেকট্রোড দুটিকে বাহ্যিকভাবে সংযুক্ত করা হয় তখন ইলেকট্রনগুলো ঋনাত্মক ইলেকট্রোড জিঙ্ক থেকে ধনাত্মক ইলেকট্রোড কপারের দিকে অগ্রসর হয়। ইলেকট্রনের ঋনাত্মক আধান থাকার কারণে ইলেকট্রন প্রবাহের বিপরীত দিকে বিদ্যুত প্রবাহিত হয়। একই সময়ে ইলেকট্রোলাইটের ভিতর দিয়ে সমান পরিমাণ আয়নিক প্রবাহ চলে। বহিঃস্থ সংযোগের মাধ্যমে প্রতি দুটি ইলেকট্রন জিঙ্ক ইলেকট্রোড থেকে কপার ইলেকট্রোডের দিকে প্রবাহিত হবার সময় একটি Zn অণূ অবশ্যই দ্রবণে Zn2+ আয়ন হিসেবে চলে যাবে এবং চলে যাওয়া দুটি ইলেকট্রনকে প্রতিস্থাপিত করবে। সংজ্ঞানুযায়ী অ্যানোড হলো সেই ইলেকট্রোড যেখানে জারণ বিক্রিয়া সংঘটিত হয়, অর্থাৎ গ্যালভানিক কোষে জিঙ্ক ইলেকট্রোড একটি অ্যানোড। কপার ইলেকট্রোডে গৃহীত দুটি ইলেকট্রন দ্রবণে গিয়ে একটি Cu2+ আয়নের সাথে যুক্ত হয়ে কপার অণু গঠন করে যা Cu ইলেকট্রোডে যুক্ত হয়। একইভাবে ক্যাথোডে বিজারণ সংঘটিত হয় বা ইলেকট্রন গৃহীত হয়, তাই এখানে কপার ইলেকট্রোডটি একটি ক্যাথোড।
কোন ইলেকট্রোডে কোন বিক্রিয়া সংঘটিত হয় তা মনে রাখার একটি সহজ পদ্ধতি হল anode ও oxidation উভয়েই ইংরেজি স্বরবর্ণ দ্বারা সূচীত হয় এবং reduction ও cathode উভয়েই ব্যঞ্জনবর্ণ দ্বারা সূচীত হয়। গ্যালভানিক কোষে অ্যানোড ঋণাত্মক চার্জযুক্ত ও ক্যাথোড ধানত্বক চার্জযুক্ত। কিন্তু সকল ক্ষেত্রে অবশ্য মনে রাখা প্রয়োজন যে, অ্যানোড এ সবসময় জারণ অর্ধবিক্রিয়া ও ক্যাথোড এ বিজারণ অর্ধবিক্রিয়া ঘটে। গ্যালভানিক কোষ এর গঠন ব্যাখ্যা করার জন্য প্রায় সময়ই ড্যানিয়েল কোষের কার্যপ্রণালী ব্যাখ্যা করা হয়। বিজ্ঞানী Daniel এই তড়িৎ রাসায়নিক কোষ আবিষ্কার করেন।
লবণ সেতু (Salt bridge ) : একটি তড়িৎ কোষে দুটি তড়িৎ বিশ্লেষ্য দ্রবণ যদি পরস্পরের সংস্পর্শে থাকে তখন তরলদ্বয়ের সংযোগ স্থলে এক প্রকার বিভব সৃষ্টি হয়। একে তরল সংযোগ বিভব বলে। এর ফলে কোষের তড়িৎ চালক বল হ্রাস পায় । সুতরাং কোষের বিভব নির্ভুলভাবে পরিমাপের জন্য তরল সংযোগ বিভব দুর করা প্রয়োজন। সাধারণত: কোষের দুটি তড়িৎদ্বার ও তড়িৎ বিশ্লেষ্য দ্রবণকে দুটি ভিন্ন পাত্রে নিয়ে পাত্র দুটির দ্রবণকে লবণ সেতু দ্বারা পরোক্ষভাবে সংযোগ করলে তরল সংযোগ বিভব হ্রাস পায় । সাধারণ KCI বা KNO3 বা NH4NO3 লবণের সম্পৃক্ত দ্রবণে সামান্য পরিমাণ অ্যাগার মিশ্রিত করে গরম অবস্থায় একটি U আকৃতির কাচনলে ভর্তি করা হয়। অত:পর শীতল হলে নলটির মধ্যে দ্রবণ জেলির মত জমে যায়। অ্যাগার ম্যাগার মিশ্রিত এরূপ সম্পৃক্ত দ্রবণ ভর্তি U আকৃতির টিউবকে লবণ সেতু বলে। লবণ সেতুর উভয় মুখ তুলা দিয়ে বন্ধ করে দুই প্রান্ত পৃথক দুটি পাত্রে রাখা দ্রবণে ডুবিয়ে রাখা হয়। এর ফলে তরলদ্বয়ের মধ্যে সরাসরি সংযোগ এড়ানো যায় এবং সম্পূর্ণ কোষে বৈদ্যুতিক সংযোগ স্থাপিত হয় ।
লবণ সেতুর ভূমিকা: লবণ সেতুর লবণের আয়নগুলো তড়িৎ বিশ্লেষ্য কোষের উভয় অর্ধকোষের দ্রবণে ব্যাপন প্রক্রিয়ার মাধ্যমে চলাচল করে। আয়নগুলো দ্রবণের সাথে কোন প্রকার রাসায়নিক বিক্রিয়া করেনা। জারণ অর্ধকোষে উৎপন্ন ধনাত্নক আয়ন বৃদ্ধি পেলে লবণ সেতু হতে ঋনাত্বক আয়ন ব্যপন প্রক্রিয়ায় দ্রবণে প্রবেশ করে চার্জের ভারসাম্য রক্ষা করে। একইভাবে বিজারণ অর্ধকোষে ঋনাত্নক আয়ন বৃদ্ধি পেলে লবণ সেতু হতে ধনাত্নক আয়ন ব্যপন প্রক্রিয়ায় দ্রবণে প্রবেশ করে চার্জের ভারসাম্য রক্ষা করে। ফলে উভয় অর্ধকোষের দ্রবণে তড়িৎ নিরপেক্ষতা বজায় থাকে। লবণ সেতু না থাকলে জারণ অর্ধকোষ ও বিজারণ অর্ধকোষে ধনাত্নক ও ঋনাত্নক চার্জের সংখ্যা বৃদ্ধি পেয়ে জারণ-বিজারণ ক্রিয়া বাধাগ্রস্থ হয় এবং বিদ্যুৎ প্রবাহ বন্ধ হয়ে যায় ।
☞ শুষ্ক কোষ ( Dry Cell )
আমরা টর্চ লাইট, বিভিন্ন রকম রিমোট কন্ট্রোলার, নানা রকম খেলনা ইত্যাদি ক্ষেত্রে যে ব্যাটারি ব্যবহার করি এগুলোকে ড্রাইসেল বা শুষ্ক কোষ বলে।
ড্রাইসেল ব্যাটারি :
সাধারণ ড্রাইসেলে কার্বন দণ্ড ধনাত্মক পাত এবং দস্তার কৌটা ঋণাত্মক পাত হিসেবে কাজ করে। কার্বন দণ্ডের চারপাশে থাকে কার্বন গুড়ো ও ম্যাঙ্গানিজ অক্সাইড। ম্যাঙ্গানিজ অক্সাইড ছদন নিবারক হিসেবে কাজ করে।
দস্তার কৌটা, কার্বন গুড়া এবং ম্যাঙ্গানিজ অক্সাইডের মাঝে অ্যামোনিয়াম ক্লোরাইডের ঘন পেস্ট থাকে যা বিদ্যুৎ উত্তেজক হিসেবে কাজ করে।
শুষ্ক কোষের গঠন :
এই কোষে একটি দস্তার চোঙের মধ্যস্থলে একটি কার্বন দণ্ড বসানো থাকে। কার্বন দণ্ড কোষের ধনাত্মক পাত এবং দস্তার চোঙ ঋণাত্মক পাত হিসেবে কাজ করে। কার্বন দণ্ডের উপরে একটি পিতলের টুপি থাকে।
কার্বন দণ্ডের চারিদিকে ম্যাঙ্গানিজ ডাইঅক্সাইড ও কাঠ-কয়লার গুঁড়ার মিশ্রণ রাখা হয়। মিশ্রণসহ কার্বন দণ্ডটিকে দস্তার চোঙের মধ্যে স্থাপন করে চোঙের ফাঁকা অংশ অ্যামোনিয়াম ক্লোরাইডের ঘন পেস্ট দ্বারা পূর্ণ করা হয়।
পেস্ট যাতে শুকিয়ে না যেতে পারে সেজন্য দস্তার চোঙের উপরের মুখ পিচ, গালা, কাঠের গুঁড়া ইত্যাদি দ্বারা বন্ধ থাকে। গ্যাস বের হওয়ার । জন্য পিচের মধ্যে একটা ছোট ছিদ্র থাকে।
অতঃপর কোষের চোঙাকৃতি অংশকে কাগজে মুড়ে দেওয়া হয়।
ক্রিয়া: এ কোষকে যখন কোন বর্তনীতে সংযুক্ত করা হয়, তখন দস্তা ধীরে ধীরে দ্রবীভূত হতে থাকে এবং ইলেক্ট্রন ছেড়ে দেয়।
দস্তার আয়ন এবং বিভব পার্থক্য সৃষ্টিকারী NH4Cl এর মধ্যে রাসায়নিক বিক্রিয়া সংগঠিত হয় এবং দস্তা NH4CI থেকে ধনাত্মক আয়ন H+ মুক্ত করে নিজে ঋণাত্মক আধান ধারণ করে, ফলে দন্তার খোলের বিভব হ্রাস পায়।
এদিকে হাইড্রোজেন আয়ন (H+) কার্বন দণ্ডের কাছে গিয়ে কার্বন দন্ড থেকে দুটি ইলেক্ট্রন নিয়ে নিস্তড়িত হাইড্রোজেন গ্যাসে পরিণত হয়। কার্বন দণ্ড ইলেক্ট্রন দান করে ধনাত্মক আধানযুক্ত হয় এবং এর বিভব বৃদ্ধি পায়। ফলে দস্তার খোল থেকে কার্বন দণ্ডের দিকে ইলেক্ট্রন প্রবাহিত হয়ে তড়িৎপ্রবাহ সৃষ্টি করে ।
গৌণ ও সঞ্চয়ী কোষ
গৌণ ব্যাটারি, যা সেকেন্ডারি সেল বা রিচার্জেবল ব্যাটারি হিসাবেও পরিচিত, প্রথমবার ব্যবহারের আগে চার্জ করতে হয়; এগুলি সাধারণত ক্ষরণ অবস্থায় থাকা সক্রিয় উপকরণগুলির সাথে যুক্ত করা হয়। রিচার্জেবল ব্যাটারিগুলি বৈদ্যুতিক প্রবাহ প্রয়োগ করে পুনরায় চার্জ করা হয়, যা ক্ষরণ /ব্যবহারের সময় ঘটে এমন রাসায়নিক বিক্রিয়াকে বিপরীত দিকে ঘটায়। উপযুক্ত তড়িৎপ্রবাহ সরবরাহ করার যন্ত্রগুলিকে চার্জার বলা হয়। রিচার্জেবল ব্যাটারির প্রাচীনতম রূপটি হল লেড-অ্যাসিড ব্যাটারি, যা মোটরগাড়ি এবং নৌকা চালানোর যন্ত্রে ব্যাপকভাবে ব্যবহৃত হয়। এই প্রযুক্তিতে একটি খোলা কনটেইনারে তরল তড়িৎবিশ্লেষ্য পদার্থ থাকে, আর এক্ষেত্রে জন্য ব্যাটারিটি খাড়া করে রাখতে হয় এবং অতিরিক্ত পরিমাণে চার্জ হয়ে গেলে যাতে এর থেকে উৎপন্ন হাইড্রোজেন গ্যাস সহজে বেড়িয়ে যেতে পারে সেজন্য ভালভাবে বায়ুচলাচলের ব্যবস্থা রাখতে হয়। লেড-অ্যাসিড ব্যাটারি যে পরিমাণ বৈদ্যুতিক শক্তি সরবরাহ করতে পারে তার অনুপাতে সেটি তুলনামূলকভাবে ভারী হয়ে থাকে। যেখানে এটির ওজন এবং পরিচালনা সংক্রান্ত সমস্যার তুলনায় এর ক্ষমতা (প্রায় ১০ অ্যাম্পিয়ার) বেশি গুরুত্বপূর্ণ সেখানে এটির স্বল্প উৎপাদন ব্যয় এবং উচ্চতর তড়িৎপ্রবাহ ক্ষমতা এটিকে গ্রহণযোগ্য করে তোলে । এটির সাধারণ ব্যবহার হল আধুনিক গাড়ির ব্যাটারি হিসেবে, যা সাধারণত সর্বোচ্চ ৪৫০ অ্যাম্পিয়ারের প্রবাহ সরবরাহ করতে পারে।
☞ লেড এসিড ব্যাটারি
এক বা একাধিক কোষ সমন্বিত একটি ধারক, যেখানে রাসায়নিক শক্তি বিদ্যুতে রূপান্তরিত হয় এবং শক্তির উৎস হিসাবে ব্যবহৃত হয়। লেড এসিড ব্যাটারির প্লেট তৈরি হয় সীসা এবং লেড অক্সাইড [আরো কিছু উপাদান থাকে ঘনত্ব, শক্ত করার জন্য] এর সাথে ৩৫% সালফিউরিক এসিড ও ৬৫% পানির মিশ্রণ থাকে। এসিড পানির এই মিশ্রণটিকে বলে ইলেকট্রোলাইট যা রাসায়নিক বিক্রিয়ায় ইলেকট্রন তৈরি করে। ব্যাটারি টেস্টের জন্য হাইড্রোমিটার দিয়ে ইলেকট্রোলাইটে সালফিউরিক এসিডের পরিমাণ মাপা হয়।
লেড-এসিড ব্যাটারির ধরন : (ক)মূলত দুই ধরনের ব্যাটারি দেখা যায়, ১.ডিপসাইকেল ব্যাটারি ২.স্টার্টিং ব্যাটারি বা ক্র্যাংকিং ব্যাটারি
ডিপ সাইকেল: যা অনেকবার চার্জ ডিসচার্জে সক্ষম, এই ধরনের ব্যাটারিকে মেরিন টাইপ ব্যাটারি ও বলা হয়, এগুলো সাধারণত এভাবে স্পেসিফিকেশন লেখা হয় যেমন 12V7AH ব্যাটারি অর্থাৎ এটি ১২ ভোল্ট এর এবং ঘণ্টায় ৭ এমপিয়ার কারেন্ট দিতে সক্ষম বা ৭ এমপিয়ারে ১ ঘণ্টা চলতে সক্ষম। এগুলোতে থাকে মোটা প্লেট যা চার্জ দীর্ঘক্ষন ধরে রাখে ও ধীরে ধীরে ডিসচার্জ করতে সক্ষম।
স্টার্টিং ব্যাটারি বা ক্র্যাংকিং ব্যাটারি: এ গুলো মূলত গাড়ির ব্যাটারি। গাড়ি বা ইঞ্জিন স্টার্ট করতে বেশ শক্তিশালি একটি স্টার্টিং মোটর [যাকে সেলফ বলা হয়] থাকে এটিকে ১৫-৩০ সেকেন্ড চালু রাখলেই ইঞ্জিন স্টার্ট নিয়ে নেয়, অর্থাৎ খুব অল্প সময়ের জন্য ২৫-১৫০ এমপিয়ার কারেন্ট প্রবাহের প্রয়েজন হয় ঐ সেলফ চালাতে এর পরে আর ব্যাটারির তেমন শক্তির কোন কাজ করতে হয় না বরং ইঞ্জিন এর অলটারনেটর হতে ব্যাটারি পুনরায় চার্জ হতে থাকে। এগুলোতে থাকে পাতলা প্লেট যা অনেক বেশি কারেন্ট বা এমপিয়ার তৈরি করতে পারে।
☞ নিকেল অক্সাইড ব্যাটারি
একটি নিকেল মেটাল হাইড্রাইড ব্যাটারি (NiMH বা Ni-MH) হল এক ধরনের রিচার্জেবল ব্যাটারি। ধনাত্মক ইলেক্ট্রোডে রাসায়নিক বিক্রিয়াটি নিকেল-ক্যাডমিয়াম কোষের (NiCd) অনুরূপ, উভয়ই নিকেল অক্সাইড হাইড্রক্সাইড (NiOOH) ব্যবহার করে। যাইহোক, নেতিবাচক ইলেক্ট্রোডগুলি ক্যাডমিয়ামের পরিবর্তে একটি হাইড্রোজেন-শোষণকারী খাদ ব্যবহার করে। NiMH ব্যাটারির ক্ষমতা একই আকারের NiCd ব্যাটারির চেয়ে দুই থেকে তিনগুণ বেশি হতে পারে, উল্লেখযোগ্যভাবে উচ্চ শক্তির ঘনত্ব সহ, যদিও লিথিয়াম-আয়ন ব্যাটারির মাত্র অর্ধেক। এগুলি সাধারণত অনুরূপ আকৃতির নন-রিচার্জেবল ক্ষারীয় ব্যাটারির বিকল্প হিসাবে ব্যবহার করা হয়, কারণ এগুলি সামান্য কম কিন্তু সাধারণভাবে সামঞ্জস্যপূর্ণ সেল ভোল্টেজ বৈশিষ্ট্যযুক্ত এবং ফুটো হওয়ার প্রবণতা কম।
তড়িৎ বিশ্লেষ্য কোষ ও গ্যালভানিক কোষের পার্থক্য
| তড়িৎ বিশ্লেষ্য কোষ | গ্যালভানিক কোষ |
|---|---|
| ১. যে কোষে তড়িৎ শক্তি ব্যবহার করে রাসায়নিক বিক্রিয়া ঘটানো হয় তাকে তড়িৎ বিশ্লেষ্য কোষ বলে। | ১. যে কোষে রাসায়নিক বিক্রিয়া ঘটিয়ে তড়িৎ শক্তি উৎপন্ন করা হয় তাকে গ্যালভানিক কোষ বলে। |
| ২. তড়িৎ বিশ্লেষ্য কোষে অ্যানোড ধনাত্মক চার্জযুক্ত এবং ক্যাথোড ঋণাত্মক চার্জযুক্ত। | ২. গ্যালভানিক কোষে অ্যানোড ঋণাত্মক চার্জযুক্ত কিন্তু ক্যাথোড ধণাত্মক চার্জযুক্ত। |
| ৩. কোন মৌল বা যৌগ উৎপাদন, ইলেকট্রোপ্লেটিং, ধাতু বিশোধন প্রভৃতি কাজে তড়িৎ বিশ্লেষ্য কোষ ব্যবহৃত হয়। | ৩. তড়িৎ শক্তি উৎপাদন করার যন্ত্র যেমন- ব্যাটারি তৈরিতে গ্যালভানিক কোষ ব্যবহৃত হয়। |
